
La pandémie de COVID-19 a fait prendre conscience au monde entier de l’importance de la recherche des contacts. Il est indispensable de savoir qui est infecté, quand et où cette personne a été infectée, pour pouvoir contenir une épidémie d’infection virale. L’absence de ces connaissances a contraint la plupart des pays du monde à mettre en place des restrictions et des mesures de confinement, ce qui a entraîné de graves perturbations sociales et une récession économique mondiale.
La mise au point de tests de dépistage rapide a permis d’identifier les personnes-contacts dans les secteurs vitaux, tels que les services de santé et la distribution de denrées alimentaires. L’accès à des tests peu coûteux a également permis aux gens de s’auto-diagnostiquer et de s’auto-isoler en cas d’infection. Cela a également contribué à ralentir la propagation du virus. La Corée du Sud et l’Allemagne ont utilisé avec succès les tests pour ralentir la pandémie à plus grande échelle, dans tous les secteurs de la société (Ref. 1).
L’un des tests de dépistage rapide envisageables pour la COVID-19 est basé sur le dosage à flux latéral (LFA), également appelé immunodosage à flux latéral (LFIA) ou tests immunochromatographiques. Le test de grossesse standard que l’on peut acheter dans les supermarchés est probablement l’application la plus connue du LFA. Le LFA est un test peu coûteux, relativement fiable, robuste et facile à utiliser pour de nombreuses maladies et affections (Ref. 2).
Dans cette série de blog en deux parties, nous utilisons le logiciel COMSOL Multiphysics® pour comprendre le fonctionnement des dispositifs LFA et les défis qu’un ingénieur peut rencontrer lors de la conception de ces dispositifs.
Principe de fonctionnement des tests de dépistage rapide LFA
Si nous examinons les mécanismes qui régissent ces tests de dépistage rapide, nous constatons qu’il s’agit de microlaboratoires plutôt avancés, mais très robustes.
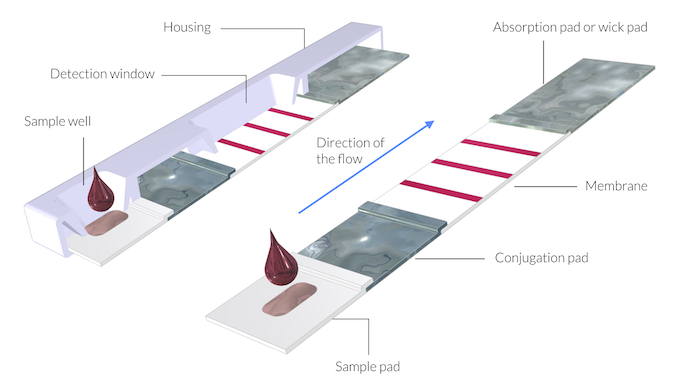
Schéma d’un dispositif de test de dépistage rapide. Ici, l’épaisseur des membranes et des tampons est exagérée d’un facteur 5 afin de montrer la structure. L’ensemble des tampons et de la membrane constitue une bandelette de test.
Le test se compose des éléments suivants (voir la figure ci-dessus) :
- Tampon d’échantillonnage
- Tampon de conjugaison
- Membrane
- Tampon d’absorption, également appelé tampon à mèche
L’assemblage des différents composants (tampons et membrane) est souvent appelé bandelette réactive. La bandelette est protégée par un boîtier en plastique (Ref. 3).
Les tampons et la membrane sont poreux. Les parois des pores doivent être humidifiées par le liquide de l’échantillon. L’échantillon peut être préparé avant d’être appliqué sur la bandelette réactive, ou il peut être préparé dans le tampon d’échantillonnage. L’échantillon est obtenu en mélangeant du sang ou de la salive avec un tampon. Le tampon peut contenir des anticorps de référence et d’autres produits chimiques, tels que des solvants qui garantissent que l’échantillon humidifie les parois des pores des différents composants.
Le tampon d’échantillonnage reçoit les gouttelettes de l’échantillon et agit comme un répartiteur de flux et comme un filtre. Les protéines et les cellules sanguines de très grande taille sont piégées dans la structure poreuse du tampon d’échantillonnage. De plus, la structure poreuse veille à ce que le liquide de l’échantillon soit réparti uniformément sur toute la largeur du tampon. Une fois que l’échantillon a rempli le tampon d’échantillonnage, il continue à s’écouler en direction du tampon de conjugaison. La force motrice de l’écoulement est la force capillaire, qui résulte de l’interaction du liquide avec les parois des pores.
Dans le tampon de conjugaison, l’échantillon filtré dissout les réactifs, appelés marqueurs de conjugaison, qui ont été appliqués sur le tampon de conjugaison au cours de la fabrication. Les marqueurs sont généralement des antigènes fixés à la surface, par exemple, de nanoparticules d’or. Un antigène peut être une protéine qui déclenche des anticorps dans le système immunitaire. Ces marqueurs peuvent se fixer aux anticorps présents dans l’échantillon, formant ainsi un complexe d’anticorps et de marqueurs de conjugaison. Les complexes sont dissous dans le liquide de l’échantillon. Ils peuvent être constitués de marqueurs attachés aux anticorps du patient et de marqueurs attachés aux anticorps de référence qui sont mélangés à l’échantillon lors de la préparation. Une fois que l’échantillon a rempli les pores du tampon de conjugaison, il se dirige vers la membrane, toujours sous l’effet de la force capillaire.
L’échantillon continue de s’écouler à travers la membrane. La membrane est généralement constituée de nitrocellulose poreuse, mais d’autres matériaux peuvent être utilisés. Différentes protéines et espèces chimiques peuvent également interagir avec les parois des pores de la membrane poreuse. Certaines espèces peuvent s’adsorber et se désorber sur les parois des pores. Cette interaction tend à séparer les différentes espèces le long de la trajectoire de l’écoulement, en fonction de la taille des molécules des espèces et de leur affinité à interagir avec la surface des pores. C’est à cette action que fait référence le terme “immunochromatographie”.
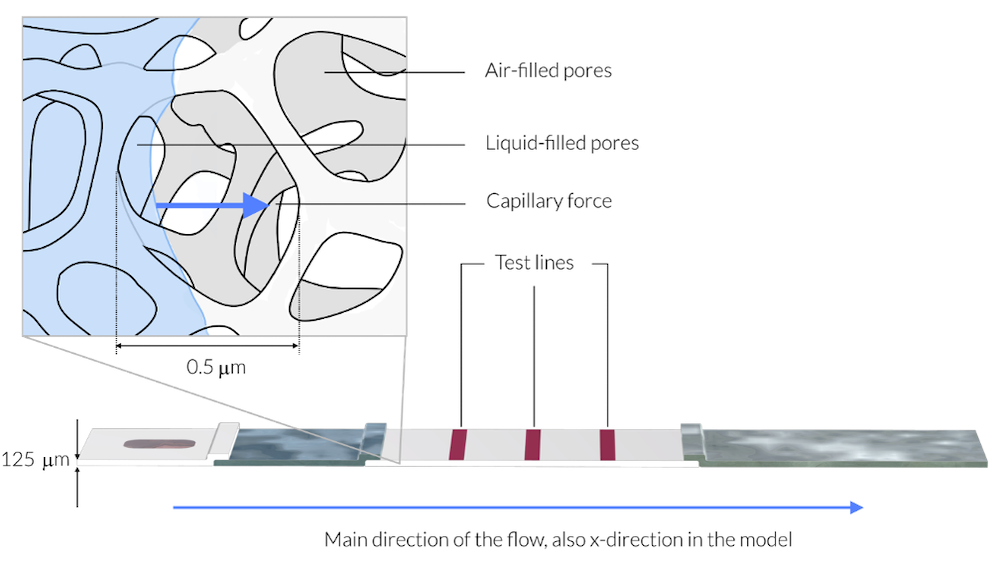
Sur cette figure, l’échantillon de liquide vient juste d’atteindre la membrane. Le grossissement montre un rectangle d’environ 1 µm de côté. Le diamètre moyen des pores est d’environ 0,5 µm. À titre de comparaison, la membrane a une épaisseur de 125 µm (Ref. 3). L’échantillon liquide est représenté en bleu clair. La membrane est constituée d’un réseau solide, comme un squelette, les pores représentant 70% du volume de la membrane. Le liquide de l’échantillon mouille les parois de la structure du squelette, les parois des pores, et est entraîné dans la direction des flèches bleues par les forces capillaires s’exerçant à l’intérieur des pores remplis d’air. Notez que l’épaisseur de la bandelette test dans ce dessin est exagérée d’un facteur 5 pour plus de clarté.
Lorsque l’échantillon entre en contact avec une ligne de test, l’un des complexes peut se fixer à une espèce de surface spécifique présente dans la région de cette ligne de test. Cette espèce de surface peut être un anticorps immobilisé sur la surface de la ligne de test. Chaque ligne de test peut fixer un complexe spécifique. Il convient de noter que l’espèce de surface est immobile dans la zone de la ligne de test ; elle n’est ni dissoute ni transportée par l’échantillon. Lorsqu’un complexe se fixe à la ligne de test, la région de la ligne de test change de couleur. La couleur indique alors qu’un complexe spécifique d’un anticorps particulier s’est fixé à la ligne de test spécifique.
La dernière ligne de test de la membrane est la ligne de contrôle. La ligne de contrôle doit toujours détecter la présence du complexe de l’anticorps de référence avec le produit chimique de conjugaison, puisque l’anticorps de référence est toujours mélangé à l’échantillon. Si la ligne de contrôle ne détecte pas ce complexe, cela signifie que l’échantillon n’a pas traversé la bandelette de manière correcte. Le test doit alors être rejeté.
Lorsque l’échantillon a rempli la membrane, il continue à s’écouler vers le tampon d’absorption, qui agit comme une mèche. Le tampon d’absorption aspire l’échantillon et cette aspiration entraîne l’échantillon à travers la bandelette réactive jusqu’à ce que le tampon d’absorption soit complètement rempli par l’échantillon.
Aperçu du modèle
Dans le prochain article de cette série, nous présenterons deux modèles de dispositif LFA. Ils révèlent plusieurs des caractéristiques observées expérimentalement par les scientifiques travaillant à la conception de ces tests. L’une de ces caractéristiques est la façon dont le débit dépend de la saturation du volume des pores de l’échantillon liquide. Ne manquez pas l’article suivant !
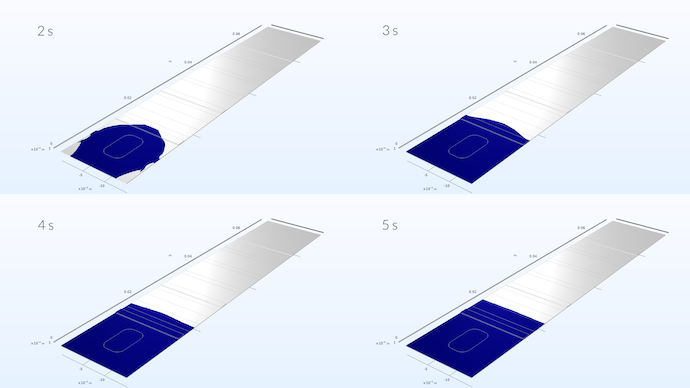
Répartition de l’échantillon de liquide dans la bande réactive. La simulation montre que l’échantillon développe un profil de vitesse plat une fois qu’il a atteint environ un tiers du tampon de conjugaison.
Références
- T. Kilic, R. Weissleder et H. Lee, “Molecular and Immunological Diagnostic Tests of COVID-19: Current Status and Challenges”, iScience, vol. 23, no. 101406, 2020, (https://www.cell.com/iscience/pdf/S2589-0042(20)30596-4.pdf).
- B.G. Andryukov, “Six decades of lateral flow immunoassay: from determining metabolic markers to diagnosing COVID-19”, AIMS Microbiology, vol. 6, no. 3, pp. 280–304, 2020, (https://pubmed.ncbi.nlm.nih.gov/33134745/).
- “Rapid Lateral Flow Test Strips, Considerations for Product Development”, Merck Millipore, 2013 EMD Millipore Corporation, Billerica, MA, USA.



Commentaires (0)